Le système Histotripsy d'HistoSonics révèle un contrôle local de la tumeur de 90 % à 12 mois dans les essais #HOPE4LIVER
- Publié le : 28 avril 2025
Un contrôle local durable et un profil d'innocuité favorable font de l'histotripsie, une alternative non invasive à la thérapie locorégionale standard.
MINNEAPOLIS--(BUSINESS WIRE)--HistoSonics, le développeur du système Edison Histotripsy, a annoncé aujourd'hui des données cliniques de suivi sur 12 mois de ses essais prospectifs #HOPE4LIVER, conçus pour évaluer l'innocuité et l'efficacité de l'histotripsie pour la destruction non invasive des tumeurs hépatiques primaires (cancer hépatocellulaire-HCC) et métastatiques.
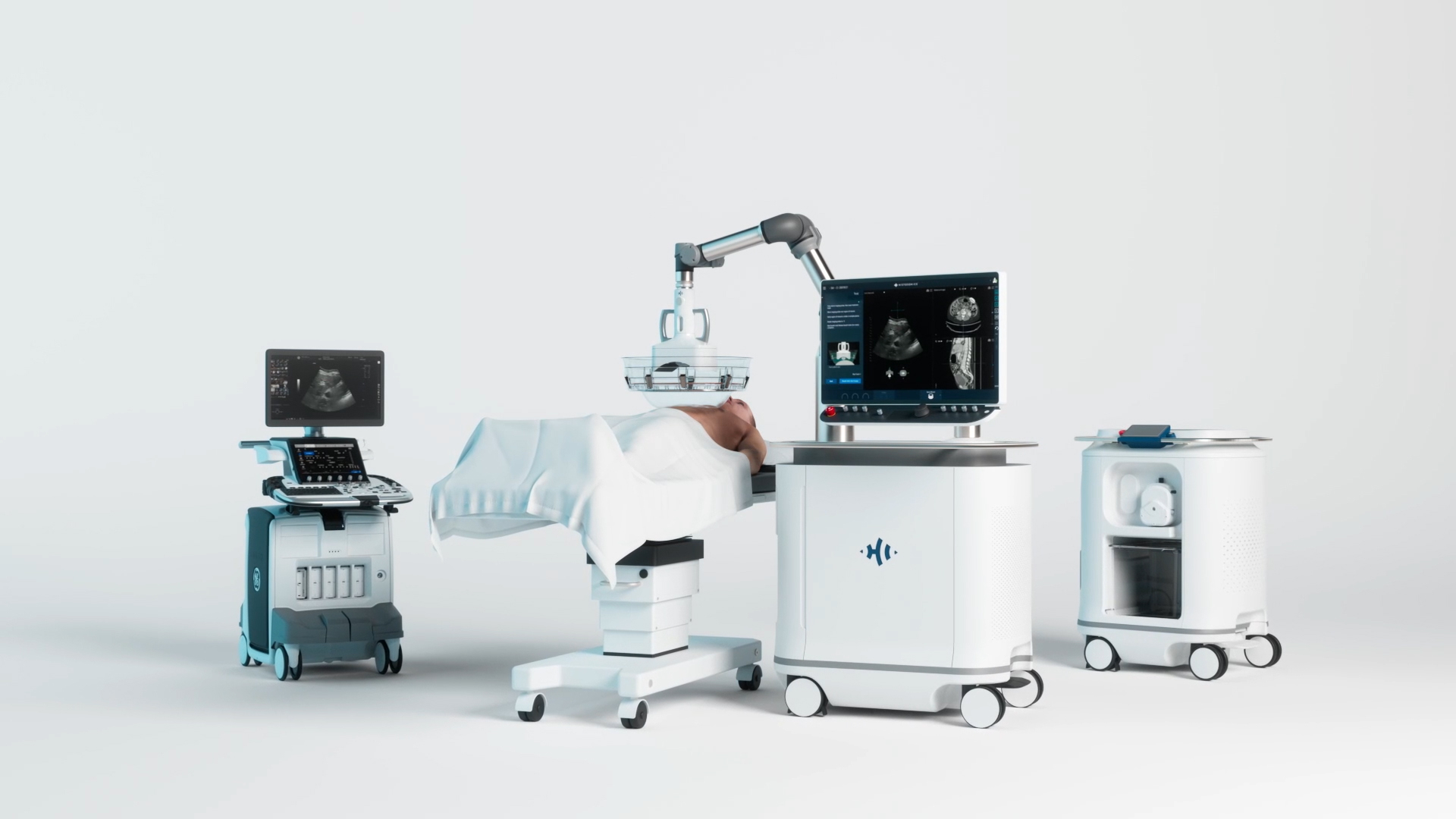



Le système Edison, qui a reçu l'autorisation De Novo de la Food and Drug Administration (FDA) des États-Unis en octobre 2023, utilise l'énergie des ultrasons focalisés pour détruire mécaniquement et liquéfier les tissus et les tumeurs ciblés sans l'invasivité ou la toxicité des procédures traditionnelles. Ces dernières données renforcent le potentiel de l'histotripsie à émerger comme une nouvelle catégorie de thérapie non invasive pour les patients atteints de tumeurs du foie.
Les essais #HOPE4LIVER ont recruté 47 patients – atteints de tumeurs primaires du foie ou de métastases hépatiques, principalement d’origine colorectale – dans 14 centres aux États-Unis, au Royaume-Uni et en Europe. Les premiers résultats de l’essai, publiés en 2024, ont été utilisés par la FDA pour soutenir l’autorisation de commercialisation De Novo aux États-Unis. Dans le cadre des essais, tous les patients traités par histotripsie avaient soit échoué aux thérapies standards, soit étaient jugés inéligibles ou intolérants à celles-ci (chirurgie, radiothérapie, ablation). Comme précédemment rapporté, le critère principal d’efficacité a été atteint avec succès dans 95,5 % des tumeurs traitées, mesuré par le nombre de tumeurs pour lesquelles une couverture complète a été obtenue (42 sur 44). De plus, le critère principal d’innocuité de l’essai a également été atteint, avec seulement 3 patients sur 44 (6,8 %) rapportant une complication majeure. Renforçant davantage le profil d’innocuité favorable, un seul effet indésirable lié au dispositif (ADE) a été signalé au-delà de 30 jours, et il a été classé comme non grave, se résolvant de lui-même.
Dix-neuf patients avaient des tumeurs provenant du foie (HCC) et 28 avaient des tumeurs métastatiques du foie, les plus fréquentes provenant du côlon ou du rectum (39,3 %). L'une des principales conclusions de l'analyse de suivi à 12 mois est un taux de contrôle local des tumeurs de 90 % observé pour toutes les tumeurs traitées, quel que soit le type ou l'origine de la tumeur, ce qui se compare favorablement aux thérapies régionales locales actuelles à un an.
L’évaluation sur 12 mois a mis en évidence la capacité unique de l’histotripsie à préserver les structures critiques riches en collagène, telles que les vaisseaux sanguins et les canaux biliaires, dans la zone traitée, grâce à son mécanisme d’action mécanique non thermique. Un laboratoire d’imagerie indépendant a réalisé des évaluations radiographiques post hoc de tous les examens de suivi afin de prendre en compte la préservation des structures vasculaires et de garantir une interprétation précise des résultats du traitement. La survie globale a été analysée à l’aide de la méthode de Kaplan-Meier, révélant des taux de survie comparables à ceux des thérapies systémiques ou combinées actuelles. Les résultats intermédiaires complets à 12 mois sont publiés dans l’édition de mai 2025 de la revue Annals of Surgery.
« C’est très encourageant de voir ces données intermédiaires à 12 mois », a déclaré le Dr Clifford Cho, directeur médical de l’University of Michigan Health-West et co-investigateur principal des essais #HOPE4LIVER. « Aussi important que fût le premier rapport de #HOPE4LIVER pour le domaine des thérapies ciblées sur le foie, il était absolument nécessaire de compléter ces premières observations par des données à plus long terme. Nous ne sommes pas encore en mesure de caractériser pleinement les effets longitudinaux de cette toute nouvelle technologie, mais ces données confirment que l’excellent contrôle local et le profil d’innocuité prometteur évoqués dans notre premier article #HOPE4LIVER sont toujours présents un an plus tard. Nous poursuivrons nos efforts avec un suivi à plus long terme, mais je pense que ces résultats appuient fortement l’adoption clinique rapide que nous avons observée pour l’histotripsie. »
« Les résultats à un an des essais #HOPE4LIVER sont vraiment remarquables, car le profil d’innocuité a été maintenu tout au long de la première année de suivi et, au fur et à mesure que nous comprenions les résultats d’imagerie post-histotripsie, il est devenu évident que l’effet du traitement était durable », a déclaré le Dr Tim Ziemlewicz, professeur de radiologie à l'Université du Wisconsin et co-investigateur principal des essais #HOPE4LIVER. « Les thérapies locales présentent généralement une longue courbe d’apprentissage avant d’atteindre des résultats optimaux, tandis que dans cet essai, des résultats équivalents à ceux d’utilisateurs expérimentés ont été obtenus, bien qu'un seul investigateur ait eu une expérience préalable dans le traitement de patients par histotripsie. Cela démontre la large applicabilité de l’histotripsie et garantit aux patients un accès à des traitements de niveau expert dès les premières étapes de l’adoption clinique. Cela augmente également le nombre de patients que nous pouvons traiter avec succès par thérapies locales, en particulier ceux présentant des tumeurs situées dans des zones critiques, comme le long des canaux biliaires centraux, où l’histotripsie devient rapidement une option de traitement de premier plan. »
L’histotripsie utilise l’énergie sonore focalisée pour créer une cavitation acoustique contrôlée, détruisant mécaniquement et liquéfiant les tumeurs hépatiques ciblées au niveau subcellulaire. La plateforme HistoSonics permet aux médecins de planifier, cibler, traiter et surveiller la destruction tumorale avec une visualisation et un contrôle continus en temps réel — des capacités inégalées par toute autre modalité existante. Après l’autorisation De Novo de la FDA obtenue en octobre 2023, le système Edison Histotripsy a été adopté avec succès dans de grands centres académiques américains, au sein de réseaux de santé intégrés et d’hôpitaux communautaires désireux d’offrir à leurs patients ce traitement non invasif révolutionnaire. D'autres essais cliniques sont en cours pour évaluer l’innocuité et l'efficacité de l’histotripsie dans le traitement non invasif des tumeurs rénales (essai #HOPE4KIDNEY, NCT05820087) et des tumeurs pancréatiques (essai GANNON, NCT06282809), en vue de futures soumissions réglementaires pour ces deux organes.
Le système Edison est destiné à la destruction mécanique non invasive des tumeurs hépatiques, y compris la destruction partielle ou complète de tumeurs hépatiques non résécables par histotripsie. La FDA n’a pas évalué le système Edison pour le traitement d'une quelconque maladie, y compris – mais sans s’y limiter – du cancer, ni pour des résultats spécifiques liés au cancer (tels que la progression locale des tumeurs, la survie à 5 ans ou la survie globale). Le système doit uniquement être utilisé par des médecins ayant suivi une formation dispensée par HistoSonics, et son utilisation doit être guidée par le jugement clinique d’un médecin formé de manière appropriée. Veuillez consulter le mode d'emploi du dispositif pour obtenir la liste complète des avertissements, des précautions et un résumé des résultats des essais cliniques, y compris les événements indésirables signalés.
À propos de HistoSonics
HistoSonics est une société privée de dispositifs médicaux ayant mis au point une thérapie exclusive par faisceau sonique et une plateforme non invasive basées sur la science de l'histotripsie, un mécanisme d'action innovant qui a recours à des ultrasons focalisés pour liquéfier et détruire mécaniquement des tumeurs et des tissus indésirables. L'entreprise concentre actuellement ses efforts sur la commercialisation de son système de traitement hépatique Edison aux États-Unis et sur certains marchés mondiaux spécifiques tout en élargissant les applications de l'histotripsie à d'autres organes comme les reins, le pancréas, etc. HistoSonics possède des bureaux à Ann Arbor dans le Michigan et à Minneapolis dans le Minnesota. Pour plus d'informations sur le système d'histotripsie Edison, rendez-vous sur : www.histosonics.com/. Pour obtenir des informations sur les patients, veuillez consulter le site suivant : www.myhistotripsy.com/.
« L'essai pivot à bras unique #HOPE4LIVER pour l'histotripsie des tumeurs hépatiques primaires et métastatiques : 1-year update of clinical outcomes » publié dans Annals of Surgery par Ziemlewicz, et.al. est placé sous licence CC BY-NC-ND.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Pour les demandes des médias
Personnes-ressources pour les médias :
Josh King
Vice-président du marketing
Email : Joshua.king@histosonics.com
Phone : 608.332.8124
Kimberly Ha
KKH Advisors
917-291-5744
kimberly.ha@kkhadvisors.com